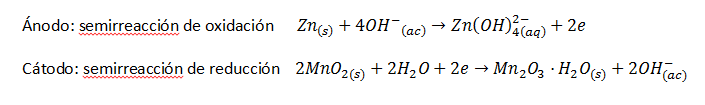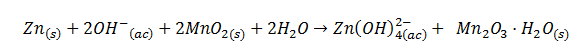L'aspecte quantitatiu de l'electròlisi
és directe: el nombre d emols i, per tant., la massa de substància
que s'oxida o es redueix en un elèctrode està relacionat amb la
quantitat d'electricitat que ha ciculat per la cel·la per
l'estequiometria de la reacció que té lloc en aquest
elèctrode.
la qual cosa significa que, per cada mol de M dipositat, circularan x mols d'electrons. Si fem cirucular una càrrega Q, es dipositarà una massa m del metall.
Vegem en un exemple com es calcula
aquesta massa:
S'han connectat en sèrie dues
cel·les electrolítiques que contenen solucions aquoses d'una sal
d'Ag+ i una altra de Fe+3. Calcula les masses
d'argent i de de ferro que s'hi dipositaran per electròlisi amb un
corrent d'1,5 A durant  3
minuts.
3
minuts.
 3
minuts.
3
minuts.
Les
semirreaccions de reducció que es produeixen en el càtode són:
Com
que estan connectades en sèrie, per les dues cel·les passarà la
mateixa càrrega:
Apliquem
factors de conversió per tal de determinar la massa de cada metall
dipositada en cada càtode:
Calcula
la massa de coure que s'obté en passar un corrent d'intensitat 6 A
durant 1 hora i 30 minuts per una cel·la electrolítica que conté
una solució de sulfat d ecoure (II)